Fibromialgia
La fibromialgia (FM) es un síndrome de dolor multifactorial que, aunque sigue sin tener una definición exacta, cada vez conocemos más acerca de la patofisiología y medidas que mejoran a los pacientes. La multidimensionalidad de la fibromialgia se deriva de sus diversos síntomas: dolor generalizado, fatiga, alteración del sueño, rigidez musculo esquelética, disfunción cognitiva, sensibilidad ambiental, trastornos del estado de ánimo, alteraciones de equilibrio y vértigo, debilidad muscular, deterioro funcional e incapacidad laboral.
Por otra parte, vemos que aparece asociada frecuentemente a otras patologías como el síndrome del intestino irritable, síndrome de piernas inquietas, la vejiga hiperactiva, dolor pélvico, vulvodinia, dispareunia, migrañas o parestesias. Además, la mayoría de pacientes con fibromialgia tienen una o más enfermedades no relacionadas con la fibromialgia, tales como osteoartritis, artritis reumatoide, obesidad, dolor lumbar, lupus eritematoso sistémico, lesiones traumáticas y alteraciones psicológicas como estrés post-traumático.
Se ha estimado que la FM afecta al 3-5% de la población. La investigación en las últimas cuatro décadas nos revela que hay varios factores que contribuyen al desarrollo de la FM. Existe evidencia científica de una alteración en la regulación de lo que llamamos modulación del dolor (transmisión y control de las señales o impulsos dolorosos que se transmiten en el sistema nervioso) y ciertos estudios de imagen muestran un aumento anormal de la respuesta a estos estímulos dolorosos, que en el resto de las personas no suele ocurrir.
Hay también evidencia de que existe una alteración en la regulación del eje simpático-suprarrenal y el eje hipotálamo-pituitario-adrenal. Aunque no hay evidencia de alteraciones a nivel microscópico o clara patología a nivel muscular, si hay cambios tales como la hipoxia e isquemia local que se cree pueden ser responsables de alteraciones bioquímicas que contribuyen a la sensibilización periférica, lo que puede derivar en un cuadro de lo que llamamos sensibilización central del dolor, que es la teoría que actualmente se cree es la responsable del dolor generalizado.
Conocemos que existen alteraciones nerviosas en las vías ascendentes y descendentes del control y transmisión del dolor a nivel cerebral, de médula espinal y nervios periféricos. Se han encontrado niveles elevados de ciertos neurotransmisores que facilitan la transmisión de señales dolorosas como glutamato, sustancia P y factor de crecimiento nervioso (NGF) en el líquido cefalorraquídeo y una disminución de la densidad de materia gris cortical a nivel cerebral.
Otros estudios han encontrado una disminución de neurotransmisores como serotonina y norepinefrina en el líquido cefalorraquídeo que actúan a nivel de vías inhibitorias descendentes de la trasmisión del dolor, lo que probablemente explica la eficacia de ciertos antidepresivos. También se ha descrito en estudios con RM Funcional una reducción de la actividad a nivel del cíngulo anterior rostral, una región del cerebro asociada con las vías descendentes inhibitorias del dolor y en estudios con PET una alteración de la afinidad por el receptor μ-opioide, lo que refleja también una alteración en la modulación que los opioides endógenos ejercen sobre el dolor.
Dada la compleja naturaleza y la etiología multifactorial de FM, los expertos cada vez más,
hacen hincapié en la importancia de emplear diferentes enfoques de tratamiento que pueden
abordar múltiples factores asociados con FM.
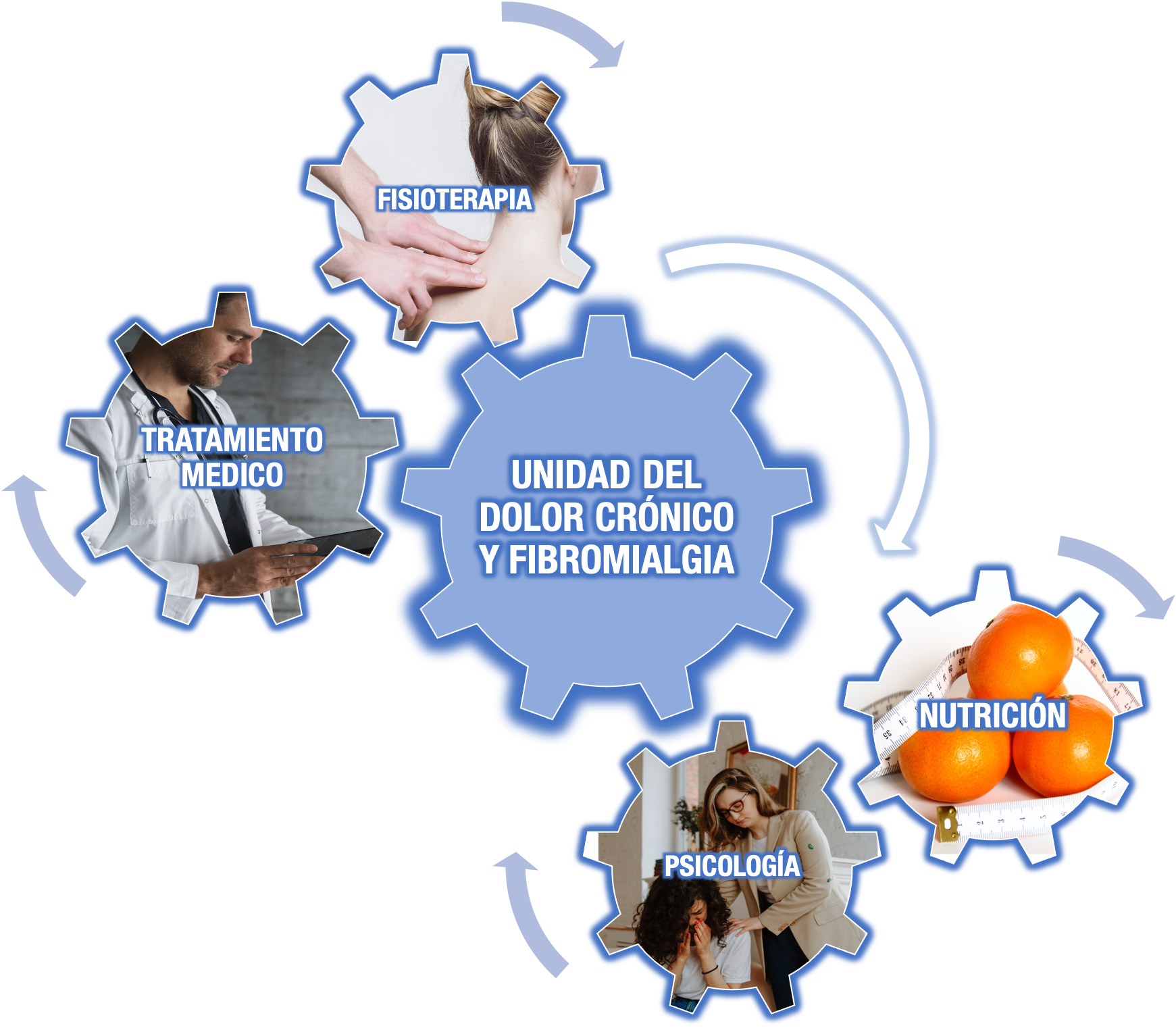
El enfoque multidisciplinario incluye:
- La educación e información sobre la enfermedad
- El ejercicio físico
- El tratamiento psicológico (terapia cognitiva conductual)
- Los tratamientos farmacológicos y técnicas más intervencionistas
- La influencia de la dieta en ciertos pacientes con FM.
Es actualmente el enfoque psicológico preferido y que se centra en pensamientos, sentimientos y comportamientos, y por lo tanto es lo más adecuado para el tratamiento de la fibromialgia desde una perspectiva psicosocial. Los componentes más importantes de la terapia cognitiva-conductual son los siguientes:
- Reforzamiento de la educación
- Centrarse en las mejoras funcionales más que la fibromialgia como una enfermedad
- Fijación de objetivos realistas
- Establecer actividades realistas, cada vez mayores
- Gestión del sueño
- Enfoque de la alteración cognitiva: uso de agendas, listas de tareas pendientes, técnicas de
atención - Ser consciente del papel del estrés en la aparición de los síntomas
- Contrarrestar los pensamientos negativos
- Recaídas y mantenimiento
- Mejorar la comunicación con los demás
- Técnicas de relajación
- Información sobre el uso de medicamentos
Se recomienda actividad física sobre el sedentarismo. Hay mucha evidencia que el ejercicio físico mejora los aspectos físicos y psicológicos en los pacientes con FM. Sin embargo, también es evidente que muchos pacientes con FM son reacios a hacer ejercicio porque que se cansan fácilmente y el esfuerzo va asociado a un aumento en el dolor. Es importante que el paciente comprenda que un “programa de ejercicios ‘ no significa necesariamente ir al gimnasio o a la piscina de forma regular. La actividad física es cualquier movimiento producido por músculo esquelético que requiere gasto de energía.
Se recomienda la combinación de aumentos de actividad diaria con medicamentos y otras modalidades. Hay pruebas convincentes de que el ejercicio induce cambios positivos en áreas del cerebro asociadas con el procesamiento del dolor. Estos resultados plantean la posibilidad de que movimiento puede ser un factor importante en la evolución de la enfermedad.
Las recomendaciones sobre el ejercicio físico que debemos dar es más un “arte” que una “ciencia”. Se sugiere retrasar la discusión sobre aumentar la actividad física o el inicio de un programa de ejercicio hasta la tercera o cuarta visita clínica. Las visitas clínicas iniciales deberían centrarse en la confirmación del diagnóstico de FM y las condiciones comórbidas, la educación y el manejo de los síntomas (dolor, el sueño, actividades diarias); sólo cuando se ha establecido una relación de confianza se puede abordar el tema de la actividad física.
Estrategias para mejorar el ejercicio en pacientes con FM:
- Estar más tiempo de pie y sentarse menos
- Caminar más
- Salir más de casa y si es necesario ayudarse de un bastón
- Si no le gusta caminar pruebe ejercicios como el yoga o taichí,
- Se puede aumentar la resistencia muscular también con pesas, máquinas, bandas elásticas.
- Si se marea al hacer ejercicio (hipotensión ortostática) tendrá que tomar bebidas isotónicas o
agua con una cucharada de sal para reducir la fatiga y sensación de mareo en el ejercicio. - La aquaterapia es una buena alternativa, pues proporciona flotabilidad y reduce el dolor, en
parte, por la acción directa sobre los receptores de temperatura y presión del cuerpo. - Encontrar un fisioterapeuta que pueda individualizar un programa de ejercicios para usted
puede ayudar mucho. Si bien las modalidades de terapia física pasivas (por ejemplo, hielo,
calor, compresión y masaje) hacen que uno se sienta bien mientras que se aplica, sus efectos
desaparecen después del ejercicio. La mayoría de las compañías de seguros limitan el número
de tratamientos de fisioterapia. - Los grupos de apoyo en fisioterapia, gimnasio o sociedades como afibrom son beneficiosos.
Ver a los demás como mejoran también ayuda en la autoestima. A medida que aumenta su
confianza, usted será más compasivo con usted mismo. Va a verse a sí mismo cada vez más de
lo que puede hacer en lugar de lo que no se puede.
- Los AINE son comúnmente utilizados por los pacientes con FM; sin embargo, ensayos de
doble ciego controlados con placebo que evaluaron los AINE en FM, (naproxeno y el
ibuprofeno), han fallado en demostrar la eficacia. Los corticosteroides y otros fármacos anti-inflamatorios fueron de los primeros fármacos que han sido estudiados, probablemente debido a su frecuente uso contra el dolor. Un estudio a
doble ciego, cruzado de prednisona, sin embargo, no ha demostrado beneficio en pacientes con FM. El estudio utilizó una dosis de 15 mg por día.
- Los ansiolíticos y los hipnóticos también son comúnmente utilizados para tratar el dolor
crónico asociado a trastornos del sueño y ansiedad. Sin embargo, los ensayos controlados que
evaluaron benzodiazepinas, zolpidem y zopiclona no pudieron demostrar mejoría en los
síntomas de FM a pesar de alguna mejora en los parámetros del sueño. Además, el uso de
estos fármacos a largo plazo puede estar asociado a tolerancia y aumento de la dosis.
- Los antidepresivos tricíclicos se encuentran entre los fármacos más estudiados en relación a
la alteración de la serotonina y la norepinefrina que es conocida en pacientes con FM. Un
meta-análisis proporciona algo de apoyo sobre el uso de antidepresivos tricíclicos en FM. Sin
embargo, no todos los pacientes se benefician de estos agentes. Se ha estimado que la
respuesta aparece en un 36 y 33% de los pacientes que toman amitriptilina y ciclobenzaprina,
respectivamente. Una reciente revisión de Cochrane alcanza la misma conclusión, la
amitriptilina puede ser beneficioso para una pequeña parte de los pacientes de FM pero
ciertamente no es una panacea.
Medicamentos aprobados por la FDA en USA.
- La pregabalina, un análogo de GABA y antiepiléptico, fue el primer fármaco aprobado por la
FDA en 2007. Un estudio multicéntrico a doble ciego, aleatorizado y controlado (RCT) con 750
pacientes mostraron una mejoría en el dolor en los que recibieron pregabalina (300-600 mg al
día) comparado con placebo, durante 14 semanas. Una revisión sistemática sugiere una mayor
eficacia de pregabalina sobre placebo en la reducción del dolor, mejoría en el sueño y la
calidad de vida pero no el estado de ánimo. Un metaanálisis de 4 RCT con más de 3000
pacientes muestra que el 40% de los pacientes tratados con pregabalina experimentaron una
mejoría del dolor del 30% frente al 28% de los pacientes que recibieron placebo.
- La duloxetina y milnacipran (no comercializado en España) son otros 2 medicamentos
aprobados por la FDA. Un estudio RCT doble ciego con dosis de duloxetina entre 60 y 120 mg
al día ha mostrado una mejoría del dolor y de la capacidad funcional del 48%. Sin embargo,
aparece una respuesta placebo importante, el 32%, como en el caso de la pregabalina. Por
otro lado, estudios a doble ciego que evaluaron milnacipran (100-200 mg al día) mostraron
mejoría significativa del dolor y una serie de síntomas en comparación con el grupo placebo.
Los datos agrupados de dos RCT mostraron que el 52-61% de los pacientes tratados
describieron una mejoría del dolor > 30% en comparación con 36% del grupo de placebo.
Además, un reciente informe del estudio a 3 años sugiere que el beneficio clínico parece ser
sostenido a largo plazo.
Otras medicaciones probadas en Fibromialgia
- Nabilona: Varios canabinodes han sido desarrollados para el tratamiento del dolor crónico.
Nabilona es un canabinoide sintético, que ha sido estudiado en la fibromialgia. Un estudio doble ciego aleatorizado cruzado comparó el efecto a corto plazo de nabilona con amitriptilina en dosis bajas en 31 pacientes con fibromialgia e insomnio crónico durante 2 semanas. La nabilona fue superior a amitriptilina. Sin embargo, no se estudiaron otros factores como el
dolor, el estado de ánimo o la calidad de vida en este breve estudio.
- Melatonina: Una revisión sistemática y meta-análisis del uso de melatonina en 1683
pacientes con trastornos primarios del sueño encontró una significativa eficacia en la
reducción y el aumento del tiempo total de sueño. En general, la calidad del sueño se mejoró
significativamente en los sujetos que tomaron melatonina en comparación con el placebo,
aunque el beneficio absoluto era más pequeño que otros tratamientos farmacológicos para el
insomnio. Sin embargo, la dosis correcta de la melatonina necesario a tratar la disfunción del
sueño no está clara. Algún estudio ha sugerido que dosis más bajas (0,3 a 1,0 mg) pueden ser
más eficaz que la disponible en el mercado, que son de tres a diez veces el valor normal
sanguíneo.
Además, dosis más altas de melatonina puede tener efectos secundarios como
dolor de cabeza, sensación de depresión a corto plazo, somnolencia diurna, mareos y
pesadillas. El uso de melatonina durante poco tiempo se sabe que es seguro, pero no se
conoce e5l efecto a largo plazo, si es continuado. En un estudio en 63 pacientes con
fibromialgia, tomando 25 mg de amitriptilina, 10 mg de melatonina o una combinación de
ambos durante 6 semanas, la melatonina solo o en combinación con amitriptilina redujo
significativamente el dolor. Por lo tanto, la combinación de melatonina con amitriptilina puede
producir una mejora en la actividad física.
- Naltrexona: Un estudio piloto examinó 10 pacientes con FM que fueron tratados con
naltrexona en dosis bajas durante un período de tiempo de 8 semanas. El dolor mejoró un 30%
en comparación con placebo y, además, presentaron una mejoría del umbral de estímulos
dolorosos mecánicos y por calor. Un nuevo estudio aleatorio doble ciego y controlado con
placebo incluyó a 31 mujeres con FM y naltrexona (4.5 mg) mostró una mejoría del dolor en
aquellos que tomaron una dosis baja naltrexona comparado con los recibieron placebo (28,8%
reducción vs reducción de 18,0%; p = 0,016) aunque no describieron mejora de la fatiga o el
sueño. No se describieron efectos secundarios.
[/vc_toggle][vc_toggle title=”Tratamientos intervencionistas” style=”round” color=”sky”]Estimulación occipital subcutánea
La estimulación occipital subcutánea (EOS) es una forma de neuromodulación. Consiste en la
implantación o inserción de un electrodo subcutáneo a nivel occipital y se realiza con anestesia
local en quirófano y de forma ambulante.
El mecanismo exacto de cómo funciona no está claro, pero se cree que actúa sobre múltiples
redes neuronales tanto en la columna vertebral como a nivel supraspinal. La EOS se ha visto
que es efectiva en cefalea crónica diaria y se vio en un estudio que en pacientes que además
padecían fibromialgia, aparecía una mejoría de los síntomas de dolor generalizado. Durante la fase de prueba mostró una reducción de la intensidad de la cefalea de al menos un 50%, además de varios síntomas de FM. Se han realizado posteriormente otros estudios aleatorios en pacientes con FM que muestra una leve mejoría de los síntomas. Al ser un tratamiento invasivo y por las posibles complicaciones y el costo del procedimiento, los resultados no apoyan su viabilidad en este momento. Sin embargo, ya que hay evidencia de alivio significativo del dolor para algunos pacientes con cefalea, ciertos pacientes con FM pueden beneficiarse del procedimiento.
Infusión de Lidocaína
La administración intravenosa de la lidocaína para tratar los síntomas de dolor tiene una larga historia. Estudios en animales con lesiones nerviosas y en humanos con dolor neuropático crónico han demostrado la generación de impulsos eléctricos ectópicos en las neuronas sensoriales y axones lesionados. El desarrollo de hiperexcitabilidad ectópica se cree que es causada por cambios en las propiedades eléctricas de la membrana axonal debidos a cambios de distribución de los canales de sodio. La lidocaína inhibe las descargas anormales a nivel de lesiones nerviosas, ganglio de la raíz dorsal y nervios espinales por medio del bloqueo de canales de sodio, de receptores de NMDA y una disminución de la sustancia P, sin afectar la conducción nerviosa normal. La lidocaína intravenosa además, promueve una disminución en la sensibilización espinal, una reducción del dolor espontáneo, de disestesias, hiperalgesia y de la alodinia. Se ha visto en diversos estudios que la lidocaína intravenosa es efectiva en diferentes dosis y regímenes para el tratamiento de varios tipos de dolor neuropático, como el dolor post-accidente cerebrovascular, neuropatía periférica, neuropatía diabética y en síndrome de dolor regional complejo I y II.
En el caso de la fibromialgia, hay estudios que la han demostrado resultados positivos en la reducción del dolor en pacientes que recibieron lidocaína en infusión. En general, la infusión de lidocaína parece producir a una reducción del dolor en algunos pacientes con FM. El tratamiento requiere varias sesiones, aunque no está todavía establecido cuantas y la dosis necesaria. El tratamiento suele realizarse con monitorización y con infusión lenta de lidocaína.
Estimulación transcraneal
Hay dos tipos de Estimulación transcraneal, la estimulación magnética transcraneal (TMS) y la estimulación eléctrica transcraneal de corriente continua (TDCS). Ambas se han utilizado desde hace años para tratar trastornos afectivos y cognitivos como la depresión mayor. También se están estudiando y aplicando en diversas condiciones de dolor crónico con resultados variables y prometedores.
La estimulación magnética transcraneal (TMS) consiste en la producción de un campo eléctrico a nivel de corteza cerebral por medio de una bobina electromagnética que se coloca sobre la cabeza del paciente, que afecta la actividad neuronal cerebral. Estudios recientes con TMS han demostrado su efectividad en ciertos aspectos de pacientes con FM, sobre todo en ciertos
test, con una reducción significativa en el Fibromyalgia Impact Questionnaire (FIQ) y la puntuación del componente mental del test SF-36, aunque no tanto en la reducción significativa del dolor.
La estimulación magnética transcraneal (tDCS) es otro tipo de estimulación cerebral no invasiva. Envía una corriente eléctrica débil a través de un par de electrodos colocados en el cuero cabelludo (normalmente a nivel frontal y parietal). La corriente se considera que modula la actividad neuronal, posiblemente en relación a la polaridad aplicada. Hay pocos estudios que han evaluado tDCS en FM y los resultados también son prometedores, mostrando alivio parcial del dolor y otros síntomas como cansancio, depresión, sueño y mejoría cognitiva. Se ha demostrado que ambos tratamientos no producen efectos secundarios, son fáciles de aplicar (sobre todo la estimulación eléctrica transcraneal) y se toleran bien.
El glutamato es un componente habitual de la dieta que en múltiples estudios se ha descrito su relación con el dolor crónico. Por ejemplo, se ha demostrado que una inyección de glutamato en el músculo masetero de la mandíbula produce dolor en sujetos sanos. También se han encontrado concentraciones de glutamato más elevadas en el líquido cefalorraquídeo de pacientes con FM y migraña, en comparación con controles sanos. Además, en pacientes con FM también se han descrito niveles más altos de glutamato a nivel cerebral en varios estudios con resonancia magnética de espectroscopia en comparación con controles sanos.
Desde el punto de vista dietético, el glutamato es uno de dos aminoácidos no esenciales de la dieta cargados negativamente (glutamato y aspartato), que además funcionan como neurotransmisores excitatorios. El aspartato actúa sobre el receptor NMDA, que es un receptor implicado en el dolor y la depresión.
Estos aminoácidos se encuentran en la dieta como aditivos alimentarios (como el glutamato monosódico, en proteínas hidrolizadas, gelatinas, concentrados de proteínas, extracto de levadura o aspartamo entre otros), así como en alimentos específicos como la salsa de soja, salsas de pescado y otros tipos de salsas preparadas (en forma de potenciadores del sabor),
botes de especias mezcladas y aromatizantes o en quesos curados, como el queso cheddar y el parmesano.
En teoría, concentraciones plasmáticas elevadas de estos aminoácidos podrían conducir a una alteración anormal (excitatoria) en la transmisión del sistema nervioso periférico, y en personas con una alteración de la barrera hematoencefálica, esto podría producir la excitación anormal en el sistema nervioso central. Hay múltiples estudios que describen mejoría de los síntomas de fibromialgia al suspender estos aminoácidos de la dieta y retorno de los síntomas al volver a tomarlos. Pero también hay otros en los que no mejoran los pacientes, por lo que no es una medida que funcione en todos los pacientes con fibromialgia.
Habría que eliminar completamente su exposición en la dieta. Generalmente, esto consiste en tener especial cuidado en la selección de los elementos como yogur, cereal y pan, salsas, edulcorantes artificiales que se están añadiendo actualmente a muchos alimentos y que son mucho más dulces que el azúcar (usar azúcar de mesa o miel). Un período de prueba de 1 mes
es ideal, aunque la mayoría de los sujetos comienzan a sentir una mejora al final de la primera semana. Además, hay dos minerales en la dieta juegan un papel clave en la regulación del receptor NMDA. El magnesio y el zinc influyen de forma negativa en la excitotoxicidad bloqueando dicho receptor. Por lo tanto, bajos niveles plasmáticos de magnesio y zinc podrían apoyar la
excitotoxicidad. Otro componente importante en la neurotransmisión glutaminérgica es la vitamina B6. Esta vitamina sirve como cofactor importante para la enzima glutamato descarboxilasa, que convierte el glutamato en GABA (un neurotransmisor inhibitorio). La deficiencia en B6 puede producir aumento de los niveles de glutamato y niveles reducidos de GABA, facilitando así la excitotoxicidad en el sistema nervioso central. El déficit de ácidos grasos omega-3 también ha demostrado aumentar la excitotoxicidad. Este efecto se piensa que es mediado por la capacidad de los ácidos grasos omega-3 de aumentar la fluidez en la
membrana celular, que podría modular el exceso de glutamato a nivel sináptico, evitando así la excitotoxicidad.
Además de los nutrientes anteriores, hay que mencionar que la excitotoxicidad puede causar un estrés oxidativo a través del aumento de la producción de reactantes de oxígeno en el sistema nervioso. El estrés oxidativo puede ser contrarrestado por medio de la ingesta dietética de antioxidantes. Los dos principales antioxidantes vitamínicos de la dieta son la vitamina C (un antioxidante soluble en agua) y vitamina E (un antioxidante soluble en grasa), aunque otras sustancias encontradas en frutas y verduras también han demostrado tener importantes propiedades antioxidantes, como el resveratrol en uvas y los polifenoles en el té verde. En conclusión, existe evidencia que ciertas excitotoxinas de la dieta pueden ejercer un papel importante en pacientes con FM. Un bajo consumo de ácidos grasos omega-3, vitamina B6, magnesio, zinc y antioxidantes también puede tener influencia en la aparición de síntomas.
